活动标题
- 国家食品药品监督管理局举行例行发布会
活动描述
- 2008年1月8日(星期二)上午10时国家食品药品监督管理局举行例行新闻发布会,注册司司长张伟介绍中药注册管理补充规定有关情况。中国网现场直播,敬请关注!
文字内容:
- 颜江瑛:
各位记者朋友大家新年好!今天是国家食品药品监督管理局2008年第一次的新闻发布会,欢迎大家出席今天的新闻发布会。今天非常高兴发布会请来国家食品药品监督管理局注册司张伟司长,还有国家食品药品监督管理局注册司的董润生处长。今天新闻发布会就一个主题,就是我们国家食品药品监督管理局出台的《中药注册管理补充规定》。大家知道我国传统医学源远流长,中药也是我们国家民族医药的代表,也是我们国家传统医学和优秀文化的重要组成部分,也是各族人民长期与疾病斗争的经验总结和智慧的结晶。它不仅在历史上为人类的生存和繁衍做出贡献,也是目前解决群体看病难、看病贵的一个重要途径。为了提高人民群众的健康水平,促进经济社会的发展,中药在这方面起了重要的作用。我们必将进一步推进我国的中药事业发展。
2008-01-08 10:00:18
- 颜江瑛:
中药有它独特的理论和诊疗技术,疗效确切、费用相对低廉。这些优点和特点为我国民族医药发展创造了空间。国家食品药品监督管理局在保护中药和促进中药发展方面有哪些政策和措施,今天我们就请国家食品药品监督管理局药品注册司张伟司长就这次出台的《中药注册管理补充规定》发布有关情况,也请各位记者提问。
2008-01-08 10:04:43
- 张伟:
各位记者朋友,大家上午好!
备受社会各界关注的《中药注册管理补充规定》(以下简称《补充规定》)的制定工作目前已经完成,今天正式颁布实施。《补充规定》是与新修订的《药品注册管理办法》相配套的第一个规范性文件,进一步细化和明确了关于中药注册管理的要求。下面我把有关情况简单介绍一下。
2008-01-08 10:05:32
- 张伟:
一、起草背景
2007年7月10日我局发布了新修订的《药品注册管理办法》,确立了科学监管理念统领药品注册工作的指导思想,对药品注册管理提出了更高的要求。新办法中对中药的具体规定尚没有完全明确,需要进一步解释和说明具体条款的内涵和技术要求。
回顾1985年《新药审批办法》发布以来药品注册管理的历程,可以看到中药注册管理逐步规范和严格,中药产品安全性、有效性和质量可控性得到加强,但同时也逐渐显现一些问题,一是中医药的优势与特色还没有充分体现,二是对中药新药研制的引导不足,三是对药材来源和资源可持续利用等重视不够。
中药的特点在于有中医药理论指导及长期临床应用经验,临床优势与特色较突出。由于《药品注册管理办法》适用于所有药品,难以充分体现中药注册管理的特点。中医药界也呼吁,希望制定一个体现中医药特色的规定。
2008-01-08 10:07:05
- 张伟:
为体现中医药特色,遵循中医药研究规律,注重继承,鼓励创新,扶持促进中医药和民族医药事业发展,我局在2007年修订《药品注册管理办法》的同时,就着手《中药注册管理补充规定》的起草工作。
为做好《补充规定》的起草工作,我局由药品注册司牵头、组织有关部门人员和专家成立了专门起草小组,认真梳理相关问题,深入基层开展调研,先后组织召开20多次专题研讨会,并广泛听取各方面意见,同时上网公开征求意见。国家中医药管理局对这项工作给予了积极支持和大力配合。
可以说此次《补充规定》的制定过程是对中药注册管理的充分研讨、达成共识的过程,《补充规定》里面凝聚了医药企业、研发机构和监管部门以及社会各界的智慧和辛勤劳动。在这里,我谨代表国家食品药品监督管理局向所有关心《补充规定》制定工作的专家、学者、企业家和社会各界朋友们表示衷心感谢!
2008-01-08 10:09:23
- 张伟:
二、主要内容
本补充规定共22条,主要包括如下几方面内容:
(一)进一步明确了中药注册宏观管理的总体要求
针对中医药特点,进一步明确了中药注册管理的总体要求。坚持中药的研制必须以中医药理论为指导,强调临床实践基础,突出中医药特色。在中药质量方面,强调药材基原、产地、关键工艺参数等的重要性,保证中药质量的稳定均一。同时,注重对资源的可持续利用及对环境保护的影响,促进中药事业的健康发展。
2008-01-08 10:10:37
- 张伟:
(二)继承传统,突出中医药特色
中药复方是中医用药的特色之一,体现了中医辨证施治的治疗优势,在长期的临床实践中积累了丰富的经验,对预防治疗疾病发挥了巨大的作用。本《补充规定》着重对中药复方制剂的分类进行了细化,科学合理地制定了相关规定。
一是增加了“来源于古代经典名方的中药复方制剂”的类别。这类复方经过长期临床应用、疗效确切,所以不再要求以动物试验和临床研究证明其有效性。但是在说明书上要注明处方和功能主治的来源。此类复方的具体目录由我局协助有关部门制定并发布,以保证其安全性、有效性。
二是增加了“主治为证候的中药复方制剂”的类别。中医证候充分体现了中医特色,一直是中医药理论研究和临床研究的重点。由于动物证候模型的药效学试验难以充分体现药物的有效性,对其有效性评价的重点放在临床试验上。规定只能以中医理论和中医术语描述其功能主治,药品说明书【临床试验】项内容重点描述对中医证候的疗效,并可说明对相关疾病的影响。对此类复方制剂的组方的合理性和功能主治的规范性和准确性须组织专家审评。
由于中药基础研究较为薄弱,上述两类中药复方制剂没有经过系统的安全性评价,故在安全性上严格把关,要求必须进行临床前的安全性研究,确保用药安全。
2008-01-08 10:11:23
- 张伟:
(三)进一步鼓励中药创新
创新是中药发展的动力。依据《药品注册管理办法》第四十五条,对未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂,新发现的药材及其制剂、用于治疗艾滋病、恶性肿瘤、罕见病等疾病且具有明显临床治疗优势的中药,用于治疗尚无有效治疗手段的疾病的中药可以实行特殊审批。除此之外,为鼓励中药新药在新功能主治领域的研发,本《补充规定》还对“治疗尚无有效治疗手段的疾病的新药”增加内涵,将“主治病证未在国家批准的中成药【功能主治】中收载的新药”,纳入特殊审批的范围,充分发挥中药在疑难杂症和新出现疾病方面的治疗作用。
此外,通过提高中药改剂型和仿制品种科学合理性的要求,提高二次科研水平,引导和鼓励企业从事具有自主知识产权的新药研发。
2008-01-08 10:13:20
- 张伟:
(四)注重中药原料来源、生产过程和检测指标控制,保证质量均一稳定
近年来,中药质量标准取得了长足的进步。新技术、新仪器的推广应用,丰富了中药质量的控制手段,中药质量标准不断提高。但是在中成药生产中,由于投料的中药材基原和产地的不固定、生产工艺参数的不确定性,会对最终产品质量产生影响,甚至出现同一厂家同一品种不同批次之间质量不够稳定。
因此,《补充规定》首次提出了中药研制应当明确药材来源、产地和工艺技术参数的要求,并纳入到保证中药质量的控制环节中,结合成品质量指标检测,逐步实现“源头控制”、“过程控制”和“指标控制”三者相结合的质量保证体系,保证中药质量的均一和稳定。
2008-01-08 10:14:35
- 张伟:
(五)科学合理制定改剂型的有关要求,体现临床应用优势
《药品注册管理办法》中明确了新药的概念,对改剂型品种提高了要求,要求必须提供充分的证据说明改剂型的科学合理性,并应体现临床应用优势。为贯彻《药品注册管理办法》的要求,防止改剂型的盲目性,提高研制水平,《补充规定》根据中药的特点,进一步明确了对改剂型品种的有关要求,取消了原来简单改剂型的情形,强调必须通过临床试验来证明改剂型的合理性和必要性。
(六)细化要求,保证仿制药与被仿品种的一致性
仿制药的核心要求是与被仿品种保持一致性。由于中药的作用物质基础复杂、作用机理和作用靶点不明确,对质量的影响因素较多,因此,中药仿制药不能单靠简单的质量检测指标来判断与被仿品种是否一致性。本《补充规定》根据《药品注册管理办法》对仿制药从“仿标准”转变为“仿品种” 的管理理念,规定仿制药应与被仿品种在处方组成、药材基原、生产工艺过程及工艺参数等方面保持一致性,或者通过临床试验来证明与被仿制品种质量的一致性。
2008-01-08 10:15:56
- 张伟:
(七)注重临床研究,促进临床研究水平提高
临床研究是药品研制的重要环节。本《补充规定》进一步明确了临床研究的有关要求:一是提出了临床试验中相关对照药的选择原则,以保证药品的有效性。二是遵循中药研制规律合理调整了一些申报要求,如可分阶段申报临床试验,可以补充申请方式适时调整临床用药制剂工艺和规格等。三是规定临床试验应采用生产规模的样品,从而保证批准后生产的产品与临床研究所用样品的一致性,确保产品上市后疗效的可靠性和重现性。
2008-01-08 10:18:00
- 张伟:
(八)突出民族药特点,扶持民族药的发展
民族医药是我国传统医药的重要组成部分。为突出民族药特点、鼓励民族药的发展,落实十七大关于“扶持中医药和民族医药发展”的精神,本《补充规定》专门对藏药、维药、蒙药等民族药的注册管理作出了规定。明确规定民族药的研制应符合民族医药理论,民族药的生产企业应具备相应的民族药专业人员、生产条件和能力,民族药的审评应由相关的民族药方面的专家进行。
《补充规定》中还有许多新的内容,由于时间关系,今天我先暂时介绍这些情况,国家食品药品监督管理局将会在有关媒体上对《补充规定》作进一步的解释和说明。
我们相信随着《补充规定》的出台和实施,将为规范中药新药的研发秩序,进一步保证中药产品质量,建立公平公正的市场竞争环境,扶持促进中药产业健康发展起到重要的推动作用。
为贯彻落实《药品注册管理办法》的各项规定,我局将陆续出台一些配套的规定,除了今天发布的《中药注册管理补充规定》外,还有药品技术转让注册管理规定、药品注册核查规定、药品注册特殊审批规定等也正在抓紧制定,不久将颁布实施。
今天和我一起来的还有我局药品注册司的其他同志,大家有问题可以提出来,我们会认真地和大家一起讨论,并且予以解答,谢谢大家。
2008-01-08 10:19:17
- 颜江瑛:
谢谢张伟司长。下面请记者就国家食品药品监督管理局在促进中医药发展,保障中药安全有效方面感兴趣的话题进行提问。
2008-01-08 10:21:01
- 中国医院院长杂志社记者:
我有两个问题。一个是有关中药的问题,刚刚您提到对中药仿制从“仿标准”转变为“仿品种”,我看了一下好象对厂家的要求高了,从这点来看,是不是对仿制药的标准进一步提高了门槛?第二个问题,针对上次新闻发布会提的定点生产,上次说了一些情况,我们想了解现在的进展以及以后如何监督,还有下一步有什么打算,有些什么样的计划?谢谢。
2008-01-08 10:22:28
- 张伟:
第一个问题由董处回答,第二个问题由颜司长回答。
2008-01-08 10:24:13
- 董润生:
这个问题是关键的问题。去年10月1号实施了《药品注册管理办法》,提出了仿制药要保持和被仿制药品一致性的管理理念。我们的《中药注册管理补充规定》体现了规范性问题,它依据《药品注册管理办法》的管理理念。可以讲,通过保证被仿药品和仿制药品的一致性,保护仿制的东西和原来一样的疗效。从某种意义来说,记者说的是对的,仿制药的技术门槛是提高了。
2008-01-08 10:24:36
- 张伟:
从正面说,确实技术门槛的提高不光是政府的要求,也是社会和业界的要求。因为大家知道,中国虽然是仿制药大国,但是从仿制药的市场看,从某种意义某种程度讲还是存在过多过滥的仿制,所以政府制定规则,和行业一起制定规则,就是要提高仿制药的研究、审评以及上市的标准。这也是社会的需求,也是为了更好地保证广大人民群众用药安全有效的措施。
2008-01-08 10:26:28
- 颜江瑛:
关于第二个问题,上次新闻发布会我也提到了,我们去年11月16日在新闻大厦正式发布了国家确定的10家定点企业和18个品种的廉价药品批准上市。在这十家企业的努力下,以及发改委和地方物价局的努力下,下面已经有一些产品陆续在上市。接下来,国家食品药品监督管理局也会和卫生部就有关上市的情况做一些了解。
国家发改委在1月7日实施了26个品种、47个规格的普通药品上市的最高限价。这个政策也会更进一步促进我们国家有关常用药品,特别是价格低廉药品的上市。下一步,我们随着工作的推进和对十家定点生产企业以及18个品种上市情况的了解,我相信我们国家农村和城市社区的基本用药状况会得到更进一步的改善。大家知道药品生产成本不仅包括人力成本、原料成本,同时还包括质量控制成本。所以国家发改委这次普通药品价格的上调和前段时间公布的廉价药的政策必定会保障廉价药的供应和安全有效,有关情况我们会在相应的调查结果出来以后及时向社会公布。谢谢。
2008-01-08 10:27:29
- 光明日报记者:
中药也分处方药与非处方药,这两大类是否都集中在国家食品药品监督管理局注册?
2008-01-08 10:29:35
- 董润生:
非常高兴这么多记者关心我们中药发展问题。刚才提出的问题我想中药同样和化学药一样,因为中西药品管理法律规定中药和化学药品和生物制品统属药品管理法,所以同样纳入处方药和非处方药。
2008-01-08 10:30:54
- 新华社记者:
谢谢发言人。据我们了解,中医药提高质量是离不开标准的。我想请张伟司长介绍一下,我们国家在加强中药标准制定方面的有关情况,还有国家食品药品监督管理局下一步在这方面将采取哪些措施来保证中药的质量和安全?谢谢。
2008-01-08 10:33:22
- 董润生:
中药的标准刚才谈到了仿制药的问题,为什么我们这次要细化仿制药的技术要求,原因是中药单靠一个标准来控制一个产品的质量,它非常复杂,没有十分完全可控的质量标准,这是中药面临的现状。因为它的成分非常复杂,不能把中药的每一个成分用标准体现出来,这是中药的一个特点。所以我们这次提出来仿制药要保证和被仿产品的处方组成、药材来源和生产工艺、参数的一致性,才能保证与被仿产品质量的一致性。所以,正是基于这个原因,我们近年来做了大量的工作。从提高标准本身的指标要求,前不久出台指纹图谱控制技术,也是我们对提高中药标准控制手段,控制方法和检测手段的具体措施。
目前,国家药典委员会也在科技部立了一个项目,中药的标准要有一个行动提高计划,科技部给了一些技术上的支持,目前中药标准提高工作正在抓紧进行。可以讲,我们通过这几年的控制,中药的质量标准在指标可控性方面有了大大的提高。这次《补充规定》提出一个理念,就是要从它的药材来源、基原目的和工艺参数的确定,把这两个加到整个标准控制的过程中,通过源头、过程和最后指标控制达到中药质量稳定和均一。
所以我们现在单讲标准的可控性可能难以实现对中药质量的控制。所以我们现在提出来三合一的手段,我想将会大大提高中药质量。
2008-01-08 10:34:05
- 张伟:
另外在中药标准制定方面,一个是去年年底正式成立了第九届药典委员会,启动了2010年版的中国药典修订,这里面包括中药部分的修订,正在研究和制定修订大纲。同时,国家药典委员会也在进一步对现在已有的原来局颁或者部颁的标准进行系统的整体的考虑修订工作。
刚才董处谈到的中药标准的规范技术体系的研究,在科技部进行了立项,而且有比较大的经费支持。应当说中药质量管理涉及面比较广,环节比较多,它的标准规范技术与化学药相比还是不完善的。但是这里面确实没有国际的经验可以借鉴,中药是我们国家的特色,在中药治理上我们要引领世界的水平,所以我们必须要下大力气进行系统的研究,同时要有创新。
在建立中药标准规范技术体系立项研究中有六个方面,第一个是建立中药材资源与生产标准的规范,从源头确保中药的质量。第二,建立符合中药特点的质量控制标准,为中药安全有效提供保证。第三,根据中药特点建立和完善生产规范体系,确保中药质量的生产过程。因为大家知道,中药的质量更多的是要靠生产工艺过程,包括原辅料、原材料的控制。第四,建立和完善中药研发,促进产业的技术创新。第五,建立和完善中药上市后安全性的监测与再评价规范。中药上市以后有再评价,有不良反应监测,更好的指导我们对上市药品全面系统的评价。第六,健全和完善中药注册管理,因为中药注册管理有其自身的特点,为什么我们有《补充规定》,就是因为它有这个特点,建立系统的技术审评。这是我们对中药标准下一步要做的工作。
2008-01-08 10:38:18
- 科技日报记者:
我想问一下,中药创新的概念是不是要结合科技部的一些项目开展审批、认证?
2008-01-08 10:42:25
- 张伟:
关于创新药物,确实《药品管理法》和《药品注册管理办法》里面没有提出这个概念。但是现在从国家宏观看,就是创新型国家,创新型产品等,前一阵由中国药学会组织的专家学者也就所谓的创新药物的概念做了一些研究,提出了一些定义。但是不管怎么说,我们现在在中药注册管理分类里面,像一类、二类都是按照创新药考虑的,进行注册审批和管理。
2008-01-08 10:45:13
- 颜江瑛:
中国中医药报的记者之前给我打了一个电话,他想了解我们国家在中药饮片生产方面是怎么考虑的,特别是按照国家食品药品监督管理局的要求,为了加强中药饮片的生产管理,我们要求从2008年1月1日开始,所有的中药饮片生产企业必须在符合GMP条件下进行生产。这个要求是国家食品药品监督管理局从2004年下发的《关于推进中药饮片等类别药品监督实施GMP工作通知》当中明确提出的。这个要求也是加强对中药饮片的生产质量控制。
记者也关心到,如果没有达到GMP要求的企业能不能生产。我可以告诉大家,如果没有达到GMP条件的中药饮片的生产企业是不允许生产的,只有通过认证,获得了药品生产GMP证书,这样中药饮片企业在2008年1月1日以后才能够生产。在这里我想强调一下,吴仪副总理在去年的11月30日第三次全国产品质量和食品安全现场会上,对我国药品准入提出了要求。
2008-01-08 10:46:38
- 颜江瑛:
吴仪在这个会上提出,要严格药品的生产准入,就是要严把不具备药品生产条件的企业,把这些不具备药品生产条件的企业坚决排除药品生产企业领域之外。对药品生产企业必须强调规模,强调高水准工艺,强调规范的检验检测,强调生产过程的严格控制。吴仪副总理也提出,今后一段时间,对药品生产企业要做减法,多做减法,少做加法,集中力量搞好清理整顿,该淘汰的坚决淘汰,该关闭的坚决关闭。
国家食品药品监督管理局对中药饮片生产企业在2008年1月1实行的GMP要求,也是符合这个要求。对没有达到的,我们会坚决依法进行监管。请各位记者继续提问。
2008-01-08 10:48:57
- 颜江瑛:
如果大家没有其他问题,我最后想利用这次新闻发布会回应一下几位群众的来信。最近我收到了几位群众的来信,比如云南楚雄有一位姓张的先生来的信,这些信中普遍提到共性的问题,都是在网上或者报纸上看到某某某研究机构或者某某某研究院发布的治疗风湿病、糖尿病、皮肤病的特效宣传信息或者广告,他们在购买服用后并没有达到宣传上所达到的效果。不仅仅是被骗了钱财,实际上更多的是耽误了治疗,甚至危害了健康。
在这里,我想趁这次发布会强调一下,邵明立局长曾经提出宣传教育也是国家食品药品监督管理局重要职责之一,国家食品药品监督管理局新闻发布会不仅仅是要发布国家食品药品监督管理局出台的政策法规和一些举措,同时我们要更关注公众关注的话题。今天,通过群众来信也给我一个启发。我们在给公众答疑解惑的同时,要更多为观众提供服务信息。
2008-01-08 10:51:09
- 颜江瑛:
今天,各位记者手上拿到了《如何查询药品真伪》的示意图,也是告诉公众怎样查询药品的真伪。首先你在药品包装上看看有没有国药准字号,如果没有,肯定是假冒的。如果有的话,你可以到国家食品药品监督管理局的网站上的数据栏目当中,可以在国产药和进口药的栏目输入药品的批准文号,如果显示了药品名称、批号、企业记录,那就是药品。如果没有,肯定是假冒批准文号,请公众向当地药品监督管理部门举报。群众的来信提醒我们,今后会用更有利于公众获取的形式和直观的形式,加强这方面的宣传。在我们国家食品药品监督管理局的网站上,会有很多关于药品、医疗器械、药品生产企业、药品经营企业和药品广告批准等方面的信息,大家都可以查询,也可以提高自我保护意识。
另外我还想强调一下,关于互联网上的信息。在去年的新闻发布会上,我记得是8月8日的新闻发布会,我曾经提到过,我们国家目前为止只有9家网站获得药品监督管理局批准能够进行互联网的药品交易。这9家网站中,其中只有4家可以进行非处方药品的销售。处方药品禁止在互联网上销售。
现在,这4家我想强调一下,一个是北京京卫大药房网、一个是北京金象大药房网、上海药房网、辽宁盛生药房网,这四家药房网站才能在互联网上进行非处方药的销售。其他任何在互联网上销售药品的全部是违法的,请公众进行辨识,发现以后可以进行举报。
2008-01-08 10:53:44
- 颜江瑛:
第二,现在有一些在网站上的研究机构、研究院、科研院所在网上销售所谓药品,可以说这些都是非法销售的药品。有的所谓是他们的制剂,按照《中华人民共和国药品管理法》,医院或者医疗机构的制剂只允许在本院、本医疗机构使用,不允许上市销售,也不允许做广告。通过互联网或者通过邮购形式销售的药品,除了上述4家以外,其他的全部为非法。
所以我们希望公众帮助我们共同监督。国家食品药品监督管理局前段时间对发现的非法网站,及时移交有关部门,我们的态度是坚决予以打击。前段时间国家食品药品监督管理局同我国一些综合门户网站进行了沟通,对整理和清理综合门户网站的非法药品广告采取了相应措施。现在这些综合性的门户网站,一些非法药品广告基本上得到了净化。我们再次请公众进行监督,如果发现以后可以向食品药品监督管理局或者有关部门举报,我们共同净化我国的药品市场秩序。
有关的药品安全信息,国家食品药品监督管理局会在后续的工作当中通过我们的网站不断向公众进行发布。像刚才提到如何查询药品真伪信息,今后我们还会有相应的信息在网站上发布。我们希望通过媒体进行广泛宣传,包括地方媒体,也希望一些机构能够在我们的网站上下载保护公众健康和安全用药的信息,使公众获得更多的信息。
今天的发布会到此结束,谢谢大家。
2008-01-08 11:01:26
图片内容:
 发布会开始前现场
发布会开始前现场 记者阅读资料
记者阅读资料 国家食品药品监督管理局新闻发言人颜江瑛
国家食品药品监督管理局新闻发言人颜江瑛 国家食品药品监督管理局药品注册司张伟司长介绍《中药注册管理补充规定》发布的有关情况
国家食品药品监督管理局药品注册司张伟司长介绍《中药注册管理补充规定》发布的有关情况 国家食品药品监督管理局注册司董润生处长回答记者提问
国家食品药品监督管理局注册司董润生处长回答记者提问 光明日报记者提问
光明日报记者提问 中国医院院长杂志社记者提问
中国医院院长杂志社记者提问 新华社记者提问
新华社记者提问 国家食品药品监督管理局药品注册司张伟司长
国家食品药品监督管理局药品注册司张伟司长 国家食品药品监督管理局注册司的董润生处长
国家食品药品监督管理局注册司的董润生处长 国家食品药品监督管理局新闻发言人颜江瑛回答记者提问
国家食品药品监督管理局新闻发言人颜江瑛回答记者提问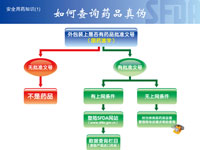 如何查询药品真伪宣传图片
如何查询药品真伪宣传图片
相关新闻:

